Риниты: иммунные и неиммунные основы гетерогенного синдрома
- Резюме
- Для цитирования
- Авторы
- Полный текст
- Литература
- Bousquet J., Khaltaev N., Cruz A.A., Denburg J., Fokkens W.J., Togias A. et al. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy. 2008; 63(suppl.86): S8–160. DOI: 10.1111/j.1398-9995.2007.01620.x
- Papadopoulos N.G., Bernstein J.A., Demoly P., Dykewicz M., Fokkens W., Hellings P.W. et al. Phenotypes and endotypes of rhinitis and their impact on management: a PRACTALL report. Allergy. 2015; 70(5): 474–94. DOI: 10.1111/all.12573
- Reshef A., Kidon-Yankovich M., Cohen-Kerem R., Rottem M., Rott Y., Agmon-Levin N. et al. Chronic rhinitis — clinical guidelines 2010. Harefuah. 2011; 150(3): 275–8, 302.
- Extreme Allergies and Global Warming, 2010, The Asthma and Allergy Foundation of America. URL: www.aafa.org (дата обращения — 15.01.2019).
- Katelaris C.H., Beggs P.J. Climate change: allergens and allergic diseases. Intern. Med. J. 2018; 48(2): 129–34. DOI: 10.1111/imj.13699
- Broźek J.L., Bousquet J, Agache I., Agarwal A., Bachert C., Bosnic-Anticevich S. et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines — 2016 revision. J. Allergy Clin. Immunol. 2017; 140(4): 950–8. DOI: 10.1016/j.jaci.2017.03.050
- Akdis C.A., Hellings P.W., Agache I., eds. Global Atlas of Allergic Rhinitis and Chronic Rhinosinusitis. Published by the European Academy of Allergy and Clinical Immunology. 2015: 232–3. URL: https://www.eaaci.org/globalatlas/ENT_Atlas_web.pdf (дата обращения — 15.01.2019).
- Hellings P.W., Klimek L., Cingi C., Agache I., Akdis C., Bachert C. et al. Non-allergic rhinitis: position paper of the European Academy of Allergy and Clinical Immunology. Allergy. 2017; 72(11): 1657–65. DOI: 10.1111/all.13200
- Ильина Н.И., Курбачёва О.М., Павлова К.C., Польнер С.А. Федеральные клинические рекомендации. Аллергический ринит. Рос. аллергол. журн. 2018; 15(4): 43–53.
- Астафьева Н.Г., Удовиченко Е.Н., Гамова И.В., Перфилова И.А., Наумова О.С. Кенесариева Ж.М. и др. Аллергические и неаллергические риниты: сравнительная характеристика (часть 2). Лечащий врач. 2013; 5: 58–65.
- Wise S.K., Lin S.Y., Toskala E., Orlandi R.R., Akdis C.A., Alt J.A. et al. International Consensus Statement on Allergy and Rhinology: Allergic Rhinitis. Int. Forum Allergy Rhinol. 2018; 8(2): 108–352. DOI: 10.1002/alr.22073
- Bunyavanich S., Schadt E.E. Systems biology of asthma and allergic diseases: a multiscale approach. J. Allergy Clin. Immunol. 2015; 135(1): 31–42. DOI: 10.1016/j.jaci.2014.10.015
- Wild C.P. The exposome: from concept to utility. Int. J. Epidemiol. 2012; 41(1): 24–32. DOI: 10.1093/ije/dyr236
- Carlin D.J., Rider C.V., Woychik R., Birnbaum L.S. Unraveling the health effects of environmental mixtures: an NIEHS priority. Environ Health Perspect. 2013; 121(1): A6–8. DOI: 10.1289/ehp.1206182
- Bousquet J., Anto J.M., Annesi-Maesano I., Dedeu T., Dupas E., Pépin J.L. et al. POLLAR: Impact of air POLLution on Asthma and Rhinitis; a European Institute of Innovation and Technology Health (EIT Health) project. Clin. Transl. Allergy. 2018; 8: 36. DOI: 10.1186/s13601-018-0221-z
- Turnbaugh P.J., Ley R.E., Hamady M., Fraser-Liggett C.M., Knight R., Gordon J.I. The human microbiome project. Nature. 2007; 449(7164): 804–10. DOI: 10.1038/nature06244
- Bäckhed F., Ding H., Wang T., Hooper L.V., Koh G.Y., Nagy A. et al., The gut microbiota as an environmental factor that regulates fat storage. Proc. Natl. Acad. Sci. USA. 2004; 101(44): 15718–23. DOI: 10.1073/pnas.0407076101
- Charlson E.S., Bittinger K., Haas A.R., Fitzgerald A.S., Frank I., Yadav A. et al. Topographical continuity of bacterial populations in the healthy human respiratory tract. Am. J. Respir. Crit. Care Med. 2011; 184(8): 957–63. DOI: 10.1164/rccm.201104-0655OC
- Bassis C.M., Erb-Downward J.R., Dickson R.P., Freeman C.M., Schmidt T.M., Young V.B. et al. Analysis of the upper respiratory tract microbiotas as the source of the lung and gastric microbiotas in healthy individuals. MBio. 2015; 6(2): e00037. DOI: 10.1128/mBio.00037-15
- Fazlollahi М., Lee T.D., Andrade J., Oguntuyo K., Chun Y., Grishina G. et al. The nasal microbiome in asthma. J. Allergy Clin. Immunol. 2018; 142(3): 834–43.e2. DOI: 10.1016/j.jaci.2018.02.020
- Chalermwatanachai T., Velásquez L.C., Bachert C. The microbiome of the upper airways: focus on chronic rhinosinusitis. World Allergy Organ. J. 2015; 8(1): 3. DOI: 10.1186/s40413-014-0048-6
- Martens K., Pugin B., De Boeck I., Spacova I., Steelant B., Seys S.F. Probiotics for the airways: potential to improve epithelial and immune homeostasis. Allergy. 2018; 73(10): 1954–63. DOI: 10.1111/all.13495
- Feinstein A.R. Pre-therapeutic classification of co-morbidity in chronic disease. J. Chronic Dis. 1970; 23(7): 455–68.
- Лазебник Л.Б. Старение и полиморбидность. Consilium Medicum. 200; 12: 993–6.
- Wedbäck A., Enbom H., Eriksson N.E., Movérare R., Malcus I. Seasonal non-allergic rhinitis (SNAR) — a new disease entity? A clinical and immunological comparison between SNAR, seasonal allergic rhinitis and persistent non-allergic rhinitis. Rhinology. 2005; 43(2): 86–92.
- Bousquet J., Schunemann H.J., Fonseca J., Samolinski B., Bachert C., Canonica G.W. et al. MACVIA-ARIA Sentinel NetworK for allergic rhinitis (MASK-rhinitis): the new generation guideline implementation. Allergy. 2015; 70(11): 1372–92. DOI: 10.1111/all.12686
- Wood R.A., Phipatanakul W., Hamilton R.G., Eggleston P.A. A comparison of skin prick tests, intradermal skin tests, and RASTs in the diagnosis of cat allergy. J .Allergy Clin. Immunol. 1999; 103(5 pt1): 773–9.
- Астафьева Н.Г., Удовиченко Е.Н., Гамова И.В., Перфилова И.А., Наумова О.С. Кенесариева Ж.М. и др. Аллергические и неаллергические риниты: сравнительная характеристика (часть 1). Лечащий врач. 2013; 4: 10–12.
- Gungor A., Houser S.M., Aquino B.F., Akbar I., Moinuddin R., Mamikoglu B. et al. A comparison of skin endpoint titration and skin-prick testing in the diagnosis of allergic rhinitis. Ear Nose Throat. J. 2004; 83(1): 54–60.
- Brown H.M., Su S., Thantrey N. Prick testing for allergens standardized by using a precision needle. Clin. Allergy. 1981; 11(1): 95–8.
- Reisacher W.R. Total and allergen-specific immunoglobulin E in the serum and nasal mucosa of a nonallergic population. Int. Forum Allergy Rhinol. 2016; 6(6): 618–23. DOI: 10.1002/alr.21709
- Buhring H.J., Streble A., Valentа P. The basophil-specific ectoenzyme E-NPP3 (CD203c) as a marker for cell activation and allergy diagnosis. Int. Arch. Allergy Immunol. 2004; 133(4): 317–29. DOI: 10.1159/000077351
- Centri Associati di Allergologia Molecolare. FABER, the screening test for IgE-mediated allergies: a precise, comprehensive, unique, and powerful tool. URL: httpss://www.caam-allergy.com/en/faber#version (дата обращения — 15.01.2019).
- Augé J., Vent J., Agache I., Airaksinen L., Campo Mozo P., Chaker A. et al. EAACI Position paper on the standardization of nasal allergen challenges. Allergy. 2018; 73(8): 1597–608. DOI: 10.1111/all.13416
- Астафьева Н.Г., Кобзев Д.Ю., Гамова И.В., Перфилова И.А., Удовиченко Е.Н., Скучаева Л.В. и др. Многоликий ринит: современный взгляд на диагностику и алгоритм лечения. Лечащий врач. 2018; 4: 7–18.
- Broźek J.L., Bousquet J., Baena-Cagnani C.E., Bonini S., Canonica G.W., Casale T.B. et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 revision. J. Allergy Clin. Immunol. 2010; 126(3): 466–76. DOI: 10.1016/j.jaci.2010.06.047
- Astafieva N., Kobzev D, Gamova I, Perfilova I, Udovichenko E. Efficacy and safety of fluticasone propionate and its generic among patients with nonallergic rhinopathy. Allergy. 2012; 67(suppl.96). Special Issue: XXXI Congress of the European Academy of Allergy and Clinical Immunology Abstract Book. Geneva, 16–20 June 2012: 859.
- Braido F., Holgate S., Canonica G.W. From “blockbusters” to “biosimilars”: an opportunity for patients,medical specialists and healthcare providers. Pulm. Pharmacol. Ther. 2012; 25(6): 483–6. DOI: 10.1016/j.pupt.2012.09.005
- Poddighe D., Gelardi M., Licari A., Del Giudice M.M., Marseglia G.L. Non-allergic rhinitis in children: epidemiological aspects, pathological features, diagnostic methodology and clinical management. World J. Methodol. 2016; 6(4): 200–13. DOI: 10.5662/wjm.v6.i4.200
- Gelardi M., Maselli del Giudice A., Fiorella M.L., Fiorella R., Russo C., Soleti P. et al. Non-allergic rhinitis with eosinophils and mast cells constitutes a new severe nasal disorder. Int. J. Immunopathol. Pharmacol. 2008; 21(2): 325–31. DOI: 10.1177/039463200802100209
- Kaliner M.A. Nonallergic rhinopathy (formerly known as vasomotor rhinitis). Immunol. Allergy Clin. North Am. 2011; 31(3): 441–55. DOI: 10.1016/j.iac.2011.05.007
- Федеральные клинические рекомендации по диагностике и лечению аллергического ринита. М.; 2018. 22 с.
- Meltzer E.O. Formulation considerations of intranasal corticosteroids for the treatment of allergic rhinitis. Ann. Allergy Asthma Immunol. 2007; 98(1): 12–21. DOI: 10.1016/S1081-1206(10)60854-X
- Bousquet J., Bachert C., Canonica G.W., Casale T.B., Cruz A.A., Lockey R.J. et al. Unmet needs in severe chronic upper airway disease (SCUAD). J. Allergy Clin. Immunol. 2009; 124(3): 428–33. DOI: 10.1016/j.jaci.2009.06.027
- Sur D.K., Plesa M.L. Treatment of allergic rhinitis. Am. Fam. Physician. 2015; 92(11): 985–92.
- Fokkens W., Hellings P., Segboer C. Capsaicin for rhinitis. Curr. Allergy Asthma Rep. 2016; 16(8): 60. DOI: 10.1007/s11882-016-0638-1
- Bernstein J.A., Davis B.P., Picard J.K., Cooper J.P., Zheng S., Levin L.S. A randomized, double-blind, parallel trial comparing capsaicin nasal spray with placebo in subjects with a significant component of nonallergic rhinitis. Ann. Allergy Asthma Immunol. 2011; 107(2): 171–8. DOI: 10.1016/j.anai.2011.05.016
- Holland C., van Drunen C., Denyer J., Smart K., Segboer C., Terreehorst I. et al. Inhibition of capsaicin-driven nasal hyper-reactivity by SB-705498, a TRPV1 antagonist. Br. J. Clin. Pharmacol. 2014; 77(5): 777–88. DOI: 10.1111/bcp.12219
Цель обзора: представление информации о современных подходах к диагностике и лечению разных фенотипов/субтипов ринитов.
Основные положения. Риниты относятся к числу распространенных респираторных заболеваний. Медико-социальное бремя ринитов часто недооценивается, поэтому врачи не торопятся с назначением терапии, а пациенты нередко игнорируют рекомендации врача, преждевременно прекращают лечение, что негативно отражается на течении заболевания, способствует развитию бронхиальной астмы, снижает качество жизни пациента.
Заключение. Концепция фенотипирования/эндотипирования заболевания, изучение механизмов развития основных форм ринита (аллергического и неаллергического) на основе омикс-технологий и современных литературных данных о роли экспосома, микробиома позволяют расширить врачебные знания и использовать их для индивидуализированной (персонализированной) терапии больных с ринитами на основе доказательной медицины.
Ключевые слова: аллергический ринит, антилейкотриены, диагноз, дифференциальный диагноз, интраназальные антигистамины, интраназальные кортикостероиды, лечение, неаллергический ринит, оральные антигистамины, таргетная терапия
Астафьева Н.Г. Риниты: иммунные и неиммунные основы гетерогенного синдрома // Вестник терапевта: сетевое издание. 2019. № 2 (38). URL: https://journal.therapy.school/statyi/rinity-immunnye-i-neimmunnye-osnovy-geterogennogo-sindroma/ (дата обращения: дд.мм.гггг).
Астафьева Наталья Григорьевна — д. м. н., профессор, заведующая кафедрой клинической иммунологии и аллергологии ФГБОУ ВО «Саратовский государственный медицинский университет имени В.И. Разумовского» Минздрава России. 410012, г. Саратов, ул. Большая Казачья, д. 112. E-mail: astang@mail.ru
Риниты относятся к числу заболеваний без серьезных фатальных исходов, таких как смерть или инвалидность, но из-за широкой распространенности (от 20% до 40% населения), изнурительных симптомов, влияния на когнитивную функцию, работоспособность и школьную успеваемость, из-за частого сочетания с такими заболеваниями как астма, атопический дерматит/экзема, пищевая аллергия, риносинусит, конъюнктивит и др., растущих расходов на медицинское обслуживание, социального бремени, влияния на качество жизни риниты, безусловно, можно считать приоритетной междисциплинарной проблемой клинической медицины [1–3].
Предполагается дальнейший рост распространенности ринитов. Оправдываются прогнозы повышения концентрация пыльцы в воздухе в связи с глобальным потеплением, накоплением СО2, увеличением продолжительности сезонов палинации, и это находит отражение в новых терминах, которые используются для оценки драматической значимости пыльцевой аллергии: пыльцевое цунами, пыльцевой вихрь, пыльцевой шторм [4, 5].
В многочисленных руководствах, клинических рекомендациях, консенсусах, инструкциях описываются эпидемиология, механизмы, диагностические процедуры, методы лечения и алгоритмы клинического ведения больных как аллергическими, так и неаллергическими ринитами [6–10].
Однако необходимы постоянная ревизия текущих знаний, усиление связи между медицинскими дисциплинами, улучшение ведения пациентов, обеспечение их медико-правовой поддержкой, информацией о новых технологиях [11]. Подходы, которые позволяют лучше представить картину аллергического и неаллергического воспаления, тесно связаны с омикс-технологиями: геномикой, транскриптомикой, протеомикой, метаболомикой, метагеномикой. Их применение приносит значимую клиническую пользу при диагностике конкретного заболевания, предсказании естественного течения болезни, определении эффективности различных вариантов лечения [12].
Новые технологии обеспечивают понимание биологического процесса на клеточном и молекулярном уровне, но чтобы полностью понять болезнь или лежащий в ее основе патофизиологический процесс, необходимо оценивать не только фундаментальные основы межклеточного взаимодействия, но и в целом взаимодействие между внутренней и внешней средой. В силу этих требований времени к традиционным «омикам» добавились микробиомика, эпигеномика, экспосомика. Их совокупность формирует беспрецедентный объем информации о человеке, которая по мере развития медицины будет становиться все более доступной и полезной.
Экспосом (exposome) — термин из области омиксных данных, описывающий совокупность факторов окружающей среды, влияющей на регуляцию генов и индивидуальное развитие организмов [13]. Хотя экспосом, в отличие от генома, транскриптома, метагенома, V(D)J-ома (гены, отвечающие за реаранжировку сегментов ДНК, принадлежащих к классам V-variable, D-diversity и J-joining, при формировании антиген-распознающих рецепторов иммуноглобулина и Т-клеточного рецептора) и других «омиков», не является внутри- или межклеточным параметром, учет вклада окружающей среды необходим для прогнозирования фенотипа организма, а также для индивидуализированного подбора лечения.
Факторы влияния экспосома на живой организм включают специфичные внешние, общие внешние и внутренние факторы.
Отдельным факторам воздействия экспосома на организм человека посвящены программы Национального института гигиены окружающей среды США по изучению влияния экологии, генетической предрасположенности и возраста на здоровье человека, а также проекты HELIX: The Human Early-Life Exposome и The Exposomics Project [14].
Окружающая среда, в том числе радиация, загрязнение воздуха, цветочная пыльца, пестициды, оказывает огромное влияние на здоровье индивида. Уже существуют и активно совершенствуются специальные датчики — беспроводные или подключаемые к смартфонам, которые позволяют отслеживать такие воздействия и делать количественные измерения — определять пыльцевые зерна, концентрации поллютантов и т. д. [15].
Инновационным подходом, оценивающим взаимосвязи между человеком, окружающей средой, здоровьем животных и безопасностью пищевых продуктов и воды, стала концепция One Health («Единый мир — единое здоровье»). Многие специалисты со значительными экспертными знаниями, работающие в разных секторах, таких как общественное здравоохранение, здравоохранение животных, охрана здоровья растений и окружающая среда, объединяют свои усилия в поддержку подхода One Health, а ВОЗ тесно сотрудничает с Продовольственной и сельскохозяйственной организацией ООН и Всемирной организацией здравоохранения животных с тем, чтобы совместно принимать меры в ответ на рост рисков в области соприкосновения экосистем людей и животных и предоставлять рекомендации по снижению этих рисков.
Создание инструментов биоинформатики для индивидуальных подходов в медицине на основе омикс-технологий сочетается с инновационными подходами, разработанными при изучении микробиома.
В Российской Федерации в рамках консорциума «Русский метагеном» выполняется «Метагеномный анализ биоценоза ЖКТ». Международный проект «Исследование состава биоты желудочно-кишечного тракта человека» (Metagenomics of the Human Intestinal Tract Consortium, MetaHIT) постоянно добавляет и анализирует новые данные, которые оказывают влияние на многие сферы клинической медицины, в том числе и на те, которые связаны с респираторным здоровьем.
Утверждение, что Homo sapiens является «суперорганизмом», в котором сосуществует большое количество различных организмов [16, 17], послужило мощным стимулом к исследованию микробиома дыхательных путей. При этом стало понятно, что ранее использовавшиеся методы культивирования микроорганизмов выявляют лишь сотую долю резидентной и транзиторной микрофлоры.
Исследования микробиомов носа, полости рта, легкого и желудка с помощью новых методов изучения микробиома (метаболомики, протеомики, транскриптомики, фингерпринтинга, секвенирования генома и др.) показали, что в отличие от других систем дыхательные пути имеют гомогенную микробиоту, которая уменьшается в биомассе от верхних отделов к нижним. Здоровое легкое не имеет обособленного микробиома, но содержит в низких концентрациях бактериальные сиквенсы, которые в значительной степени неотличимы от верхней дыхательной флоры [18].
Работы, посвященные микробиому, иллюстрируют микробиологическую непрерывность аэродигестивного тракта у здоровых взрослых, что обосновывает микробиологическую поддержку концепции о распространенности микроаспирации у здоровых людей [19].
С помощью секвенирования 16S рибосомной РНК на носовых тампонах выявлены различия в микробиоме носа у больных астмой (с обострением и стабильным течением). Так, в носовой микробиоте пациентов со стабильной астмой найдены таксоны из Bacteroidetes и Proteobacteria; при обострении астмы более широко представлены Prevotella buccalis, Dialister invisus, Gardnerella vaginalis, Alkanindiges hongkongensis. Возможны дополнительные исследования потенциальной роли выявленных носовых таксонов при астме, как биомаркеров активности астмы [20].
Нарушение связи между микробиомом и хозяином из-за измененной композиции микробиома и/или метаболизма может приводить к негативным влияниям на иммунные гомеостатические сети. Несколько исследований показали, что изменения в составе микробиома ассоциируются с многими хроническими воспалительными заболеваниями, включая аллергию, астму, риниты. Однако до сих пор неясно, изменения в микробиоме предшествуют или являются результатом болезни. Пробиотические бактерии, в основном лактобациллы, могут способствовать экспрессии и регуляции адгезивных контактов, обеспечивающих целостность и механическую плотность тканей, это приводит к восстановлению дефектов эпителиального барьера в дыхательных путях. Манипуляция микробиотой или введение здоровой микрофлоры могут оказаться полезными для лечения воспалительных заболеваний дыхательных путей. Характер и степень полезных эффектов варьируют в зависимости от штамма пробиотика и пути введения. Недавние исследования демонстрируют, что непосредственное введение пробиотика в носовую полость оказывает терапевтическое воздействие при заболеваниях верхних дыхательных путей [21, 22].
Важно отметить, что от взаимодействия микробиома с иммунной системой зависит баланс между формированием иммунной толерантности и воспалением.
Проекты, исследующие постгеномные технологии в сочетании с влиянием окружающей среды, создают прочный фундамент для индивидуализации медицины, определения наименее затратных вмешательств для снижения риска развития аллергических и неаллергических заболеваний, в том числе ринитов.
В дополнение к указанным направлениям идет активное обсуждение новой концепции мультиморбидности в клинической иммунологии и аллергологии.
Коморбидность — наличие нескольких хронических заболеваний, связанных между собой единым патогенетическим механизмом [23]. Мультиморбидность — сочетание множества хронических или острых болезней и медицинских состояний у одного человека (National Library of Medicine). По определению National Guideline Centre, это наличие двух или более хронических (или рецидивирующих) состояний/заболеваний, не связанных между собой доказанными на настоящий момент патогенетическими механизмами [24].
В основе понятия мультиморбидности в отличие от коморбидности лежит не заболевание, а конкретный пациент с множеством приобретенных хронических заболеваний, равнозначных между собой. Эксперты считают этот термин более правильным, чем коморбидность, поскольку первопричина аллергической патологии плохо изучена [25].
Мультиморбидность при ринитах и астме связана со старением населения и увеличением общего количества пожилых людей, страдающих ими. Этот важный аспект обсуждается в документе MACVIA-ARIA, который вводит новую концепцию аллергической мультиморбидности [26]. Тактика ведения пациентов с мультиморбидностью должна быть направлена на обеспечение возможно оптимального в данном состоянии качества жизни с учетом индивидуальных потребностей человека, его предпочтений в лечении, приоритетов образа жизни и целей, снижения бремени лечения, количества неблагоприятных явлений и незапланированных госпитализаций.
Мультиморбидность может изменить клиническую картину заболевания, поэтому у таких пациентов очень важно использовать единые диагностические критерии на основании существующих рекомендаций по отдельным заболеваниям.
Что касается ринитов [9, 27, 28], то для их диагностики используются традиционные подходы (анализ жалоб, анамнеза, физикального обследования, характера клинических симптомов, результатов лабораторных и инструментальных исследований, консультация оториноларинголога и аллерголога). Для оценки тяжести заболевания, влияния его на качество жизни пациента предлагаются:
• валидизированные вопросники и тесты;
• оценка тяжести назальных симптомов Total Nasal Symptom Scores — общая оценка назальных симптомов;
• вопросники по оценке качества жизни;
• Control of Allergic Rhinitis and Asthma Test (CARAT10) — тест по контролю над аллергическим ринитом (АР) и астмой), он характеризует симптомы на протяжении 4 недель и направлен прежде всего на оценку контроля симптомов пыльцевой аллергии;
• визуальная аналоговая шкала.
Для этиологического диагноза АР обязательным является аллергологическое обследование.
Кожный прик-тест может проводиться у пациентов любого возраста, выполняется быстро, а аллергены вводятся на ограниченную глубину, что уменьшает дискомфорт и минимизирует риск анафилактических реакций. Чувствительность кожного прик-теста составляет 85–88%, а специфичность — 77% .
Исследование специфических IgE (sIgE) в сыворотке крови обладает сравнимой с кожными тестами чувствительностью (67–96%) и специфичностью (80–100%) . Его результаты имеют отличную корреляцию с результатами кожного прик-теста и провокационного теста [29].
Тесты in vitro и in vivo нельзя считать полностью взаимозаменяемыми. По некоторым данным, современный прик-тест к аэроаллергенам может быть на 25% более чувствителен, чем серологические тесты, в зависимости от методологии и популяции пациентов [30].
С развитием методов аллергодиагностики появилась возможность исследования уровня sIgE в назальном секрете (пока не в рутинной практике), но в научных целях sIgE может использоваться наряду с провокационной пробой для диагностики локального АР [31]. Как исследование второй линии для диагностики АР может найти применение тест активации базофилов, но он нуждается в дополнительной стандартизации [32].
Молекулярная, или компонентная, аллергодиагностика имеет высокую специфичность, позволяет отличить перекрестную аллергию от истинной полисенсибилизации, выявить маркеры низкого и высокого риска прогрессирования заболевания, а также более точно выбрать аллергены для аллерген-специфической иммунотерапии (АСИТ). Для некоторых пыльцевых аллергенов она позволяет прогнозировать и нежелательные реакции при проведении АСИТ [33].
Для уточнения диагноза при возникновении расхождений между данными анамнеза и других методов диагностики, а также при множественной сенсибилизации к различным аллергенам и необходимости выбора клинически значимого аллергена для проведения АСИТ делают провокационные тесты. Последняя позиционная статья по стандартизации назального провокационного теста опубликована в 2018 г. [34].
Несмотря на то что АР и неаллергические риниты (НАР) отличаются по вовлеченности иммунной системы в патогенез заболевания, диагностические подходы у пациентов с ринитами без участия иммунных механизмов (НАР) такие же, как при АР.
Существуют некоторые клинические отличия между этими формами болезни [35]:
• пациенты с НАР чаще отмечают заложенность носа и насморк, а не чихание и зуд, которые являются преобладающими симптомами АР;
• у пациентов с НАР симптомы, как правило, развиваются в более позднем возрасте;
• общие триггеры НАР — изменения в погоде и температуре, воздействие продуктов питания, парфюмерии, запахов, дыма и т. п.;
• контакт с животными, как правило, не приводит к появлению симптомов у больных с НАР;
• у пациентов с НАР меньше жалоб на сопутствующие симптомы аллергического конъюнктивита (зуд, слезотечение, покраснение и припухлость);
• многие пациенты с НАР отмечают неэффективность антигистаминных препаратов;
• пациенты с НАР не имеют других атопических заболеваний, таких как экзема или пищевая аллергия, и не имеют семейного анамнеза атопии;
• больные с НАР, как правило, старше, чем с АР (средний возраст — 42,6 против 35,8 года соответственно); НАР чаще диагностируется у женщин.
Однако дифференциация между АР и НАР нуждается в более надежных и точных тестах. Основные принципы терапии АР в соответствии с основными международными рекомендациями Allergic Rhinitis and its Impact on Asthma (ARIA) ревизии 2008–2016 гг., Международным консенсусом PRACTALL, Федеральными клиническими рекомендациями [1, 2, 6, 9, 36, 37] представлены в таблице 1.
Таблица 1. Принципы ступенчатой терапии при ринитах
* Необходимы ревизия диагноза, оценка приверженности к лечению, коморбидности, анатомических аномалий перед принятием решения о переходе на более высокую ступень.
Примечание: АГП — антигистаминные препараты, АЛТР — антагонисты лейкотриеновых рецепторов, ГКС — глюкокотрикостероиды.
Изменение терапевтических подходов к лечению респираторной аллергии (астмы и ринита) связано с развитием персонализированной, прецизионной медицины и постепенной заменой «препаратов-блокбастеров» (ГКС, антигистаминов, антагонистов лейкотриеновых рецепторов) биологическими и малыми молекулами для таргетной терапии (например, омализумабом) [38]. Такие тенденции будут сохраняться и в будущем.
Некоторые методы могут использоваться при и АР, и при НАР, однако фармакотерапия НАР имеет некоторые особенности.
Важно прекращение курения. Активное и пассивное курение становится триггером как АР, так и НАР, приводят к более частому использованию лекарственных средств и в бóльших дозах.
У взрослых и детей с сезонным или персистирующим АР отдается предпочтение интраназальным ГКС (ИнГКС) перед пероральными и интраназальными антигистаминными препаратами, а также перед антагонистами лейкотриенов.
ИнГКС признаны эффективными и для лечения НАР разных фенотипов/субфенотипов и особенно при нейрогенных, сосудистых симптомах и НАР с эозинофильным синдромом (НАРЭС).
Однако есть подгруппа пациентов НАР, не отвечающих на лечение ИнГКС. Они нуждаются в подборе индивидуальной терапии, включая комбинированные препараты с ИнАГП и капсаицин.
Выбор терапии при НАР будет зависеть от индивидуальной клинической картины, его основных фенотипов/субтипов. В современной фенотипической классификации НАР [8, 39] принято выделять:
• НАРЭС, для которого описаны 4 цитологических субфенотипа: 1) НАР с эозинофилами, 2) НАР с тучными клетками, 3) НАР с нейтрофилами, 4) НАР с эозинофилами и тучными клетками [40];
• лекарственно-индуцированный НАР;
• гормональный ринит;
• профессиональный ринит (индуцированный низкомолекулярными химическими соединениями/ирритантами);
• ринит пожилых людей;
• вызванный пищевыми продуктами/алкоголем ринит;
• идиопатический НАР.
Исключены из перечня субтипов НАР следующие проявления:
• редкие клинические феномены, мимикрирующие под НАР (ликворея);
• анатомические/механические аномалии носа;
• хронические риносинуситы;
• изменения функции слизистой носа, обусловленные аутоиммунными и иными системными процессами.
Для лечения НАР подходят ИнГКС, которые утверждены Food and Drug Administration в США и European Medicines Agency в Европе. ИнГКС оказывают универсальное воздействие на острое и хроническое воспаление (так называемые «лекарства-блокбастеры»). При их использовании при остром воспалении наблюдается торможение активации клеток, уменьшение взаимодействия клеток, проницаемости сосудов, при хроническом воспалении — снижение количества воспалительных и тучных клеток, гранулоцитов, торможение повреждения эпителия. Рекомендуются ИнГКС в спрее [7, 41, 42].
В то же время не рекомендуется длительная системная терапия (пероральный прием, в/м или в/в введение, депонированные ГКС) или терапия топическими ГКС с не соответствующей системой доставки (нанесение мазей, пульверизация, фонофорез).
Оральные и интраназальные антигистаминные препараты
Антигистаминные препараты 2-го поколения (внутрь, местно) могут использоваться при НАР как средства первой или второй линии (уровень доказательности А) [8, 35]. Антигистаминные препараты 1-го поколения (когда доступны средства 2-го поколения) в связи с седативным эффектом, негативным влиянием на когнитивные функции, астму и другие сопутствующие заболевания не назначаются. Топические антигистамины (при конъюнктивитах, ринитах) в целом хорошо переносятся, и самым частым нежелательным явлением признается неприятный вкус.
Интраназальные глюкокортикостероиды для лечения аллергического ринита
В сравнительных исследованиях ИнГКС были более эффективны в отношении назальных симптомов АР, чем пероральные антигистаминные и антилейкотриеновые препараты.
Между отдельными представителями этой группы не обнаружены статистически значимые различия в эффективности.
Важным фактором, влияющим на предпочтения пациентов и приверженность к терапии, становятся сенсорные характеристики препаратов, которые включают послевкусие, запах, вытекание из носа и стекание по задней стенке глотки.
Сенсорные характеристики интраназальных глюкокортикостероидов [43]
Дискомфорт при использовании назальных спреев — запах, вкус, послевкусие, вытекание из носа и затекание в глотку, жжение и другие неприятные ощущения в полости носа — имеет клиническое значение и влияет на приверженность больных АР к проводимой терапии.
Этот дискомфорт, наряду с такими факторами, как боязнь побочных эффектов или потери эффективности при длительном лечении, представляет собой один из барьеров для оптимального применения ИнГКС.
Большинство пациентов отчетливо дифференцируют разные препараты по сенсорным характеристикам, и современные клинические рекомендации поддерживают учет мнения самого пациента при выборе интраназального препарата.
Отработка оптимальной техники введения интраназальных глюкокортикостероидов [1, 6, 11, 35, 36]
Оптимальная техника введения назального спрея подразумевает небольшой наклон головы вперед и направление наконечника слегка кнаружи от средней линии во избежание контакта с носовой перегородкой.
Такое распыление способствует созданию более высоких концентраций препарата на боковой стенке полости носа, где находится максимальное количество клеток мерцательного эпителия, участвующего в аллергическом воспалении, а также снижает риск носовых кровотечений.
Поскольку носовые кровотечения чаще отмечаются со стороны доминирующей руки, многие эксперты рекомендуют пользоваться при распылении спрея противоположной рукой (контрлатеральная техника).
Не у всех пациентов со средне-тяжелым и тяжелым ринитом возможно достижение оптимального контроля симптомов. По аналогии с больными АР, по мнению экспертов European Academy of Allergy and Clinical Immunology, «большинство пациентов с НАР могут получать лечение одним препаратом, но при тяжелых персистирующих симптомах комбинированная терапия может быть возможным вариантом» [41, 44, 45]. Им могут быть назначены топические комбинированные препараты (ИнГКС + антигистаминные): азеластин + флутиказон; мометазона фуроат + азеластин.
Другие препараты для лечения ринитов:
• антагонисты лейкотриеновых рецепторов рекомендуются ARIA для лечения больных с сочетанием АР и бронхиальной астмы (Ev.А);
• ипратропия бромид играет вспомогательную роль у больных АР с персистирующей ринореей (Ev.В);
• деконгестанты рекомендуется использовать их не более 3 дней во избежание «эффекта рикошета» и подавления мукоцилиарной активности (Ev.В);
• препараты кромоглициевой кислоты лучше всего применять для профилактики до начала сезона пыления растений (Ev.А);
• максимальный эффект интраназального введения раствора хлорида натрия у взрослых обеспечивает буферный изотонический раствор, а у детей — гипертонический (Ev.А).
При фенотипах НАР, связанных с нейрогенным воспалением (идиопатический ринит, ринит, вызванный холодом), обнадеживающие результаты получены при использовании капсаицина [46, 47].
Капсаицин — природный раздражитель, который получают из кайенского перца. Работающие с ним специалисты пишут: «Хотя его действие несмертельно, но Вы пожалеете, что не умерли, когда его вдохнете» (L. Matheson, Университет штата Айова).
Побочные эффекты при интраназальном использовании капсаицина включают раздражение, жжение, чихание и кашель, однако не известно о каких-либо долгосрочных побочных его эффектах. Капсаицин вызывает даун-регуляцию экспрессии временных рецепторных потенциалов ваниллоидных (TRPV) рецепторов на С-сенсорных волокнах, что приводит к нарушению работы каналов, участвующих в генерации ощущений боли, холода, жара, вкусов, давления и зрения. Продолжаются исследования по клиническому применению капсаицина .
В настоящее время использование капсаицина ограничено из-за отсутствия стандартизированных растворов для назального применения [48].
Группы лекарственных средств для воздействия на конкретные симптомы НАР представлены в таблице 2 [8, 35].
Таблица 2. Влияние различных фармакологических препаратов на отдельные симптомы неаллергического ринита
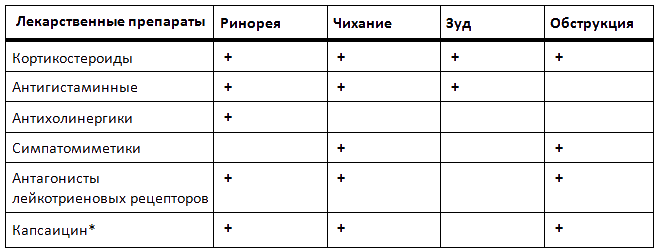
* Использование ограничено из-за отсутствия стандартизированных растворов для назального применения.
Заключение
Концепция фенотипирования/эндотипирования заболевания, изучение механизмов развития основных форм ринита (аллергического и неаллергического) на основе омикс-технологий и современных литературных данных о роли экспосома, микробиома позволяют расширить врачебные знания и использовать их для индивидуализированной (персонализированной) терапии больных с ринитами на основе доказательной медицины.
Следующая статья
О широком распространении бронхиальной астмы свидетельствуют данные эпидемиологического исследования...